CRISPR-Cas系统广泛存在于细菌和古细菌中,是原核生物的一种适应性免疫系统,用来抵御病毒、质粒等外源核酸的侵入。然而在2013年,有研究人员在ICP1噬菌体中发现了I-F型CRISPR-Cas系统。噬菌体的CRISPR-Cas系统相较于细菌CRISPR-Cas系统有何特点尚待研究。
2024年7月8日,我校冯越课题组与清华大学杨茂君课题组合作在Nature Chemical Biology发表了题为“Cas1 mediates the interference stage in a phage-encoded CRISPR–Cas system”的研究长文以及“An alternative mechanism for recruiting Cas2/3 in a phage-encoded CRISPR–Cas system”的研究简报,报道了ICP1噬菌体CRISPR-Cas系统独特的招募Cas2/3降解靶DNA的机制。

本文通过结构生物学、生物化学和噬菌体学等多种手段阐明了ICP1 CRISPR-Cas系统复合物全新的招募Cas2/3的分子机制。首先,他们发现ICP1 Cas1可以结合ICP1 Csy或Csy-dsDNA复合物,而铜绿假单胞菌的Cas1并不能结合其Csy或Csy-dsDNA复合物;其次,ICP1 Cas1-Cas2/3复合物结合ICP1 Csy-dsDNA后,可以形成稳定的Csy-dsDNA-Cas1-Cas2/3复合物,该复合物由冯越课题组和杨茂君课题组合作解析(图1)。该复合物中,Cas1-Cas2/3复合物位于中心,两侧各结合一个Csy-dsDNA复合物,总分子量约1 MDa,这也是首个I-F型CRISPR-Cas系统结合Cas2/3的复合物结构,而铜绿假单胞菌Cas1-Cas2/3结合其Csy-dsDNA后,Cas1会逐渐从Cas2/3解离下来,最终只能形成Csy-dsDNA-Cas2/3复合物;最后,体内和体外的活性实验证明,ICP1 Cas2/3只有在Cas1存在时,才能更好地降解Csy复合物靶向的DNA,而铜绿假单胞菌Cas1几乎不影响Cas2/3降解靶DNA。结合以上结果,冯越课题组提出了ICP1 CRISPR-Cas系统由Cas1招募Cas2/3进行靶DNA降解的新机制。
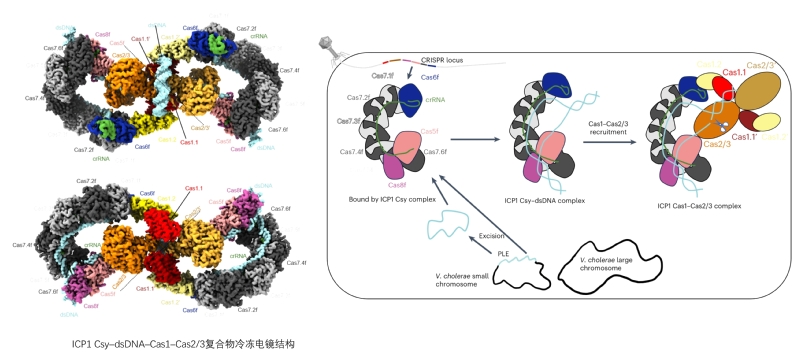
图1 ICP1 I-F型CRISPR-Cas系统干扰机制
综上所述,Cas1在ICP1 CRISPR-Cas系统中通过连接Csy复合物和Cas2/3来介导靶DNA的降解。这一发现展示了Cas1在CRISPR-Cas系统干扰阶段的关键作用,打破了领域内长期以来关于其仅在适应阶段发挥作用的传统观念。清华大学张来幸博士、北京化工大学王浩博士、清华大学曾建伟博士、北京化工大学曹雪利博士和已毕业硕士生高政宇为本论文的共同第一作者,北京化工大学冯越教授,张怡副教授与清华大学杨茂君教授为本文的共同通讯作者。
原文链接:
https://www.nature.com/articles/s41589-024-01659-5
https://www.nature.com/articles/s41589-024-01667-5
冯越教授简介:
冯越,北京化工大学教授,博士生导师,国家优秀青年基金获得者(2018)。主要以生物化学与分子生物学、结构生物学、细胞生物学等为手段,对微生物与宿主免疫系统相互作机制开展研究。共发表SCI论文50篇,其中通讯作者(含共同)论文27篇,分别发表在Nature、Cell、Mol Cell、Nat Chem Biol、PNAS、Nat Plants、Nat Commun、Nucleic Acids Res等国际著名期刊。作为负责人主持国家及省部级项目多项。曾获得全国青年岗位能手(2020)、北京市优秀青年人才(2020)、北京市科学技术进步奖二等奖(2018)、中国十大新锐科技人物(2018)、北京市科技新星(2019)等荣誉。


